向某NaOH溶液中通入CO2气体后得溶液M 因CO2通入量的不同 溶液M的组成也不同。若向M中逐滴加
向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA﹕AB=2﹕3, OA=AB, OA﹕AB=3﹕2,则下列分析与判断不正确的是(忽略CO2的溶解)( )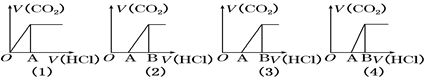
|
参考解答
| C |
CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H20, 当n(CO2)/ n(NaOH)≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余; 当1/2<n(CO2)/ n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3; 当n(CO2)/ n(NaOH)≤1/2,反应按②进行,等于1/2时,CO2、NaOH恰好反应生成Na2CO3;小于1/2时,生成Na2CO3,NaOH有剩余; 向M中逐滴加入盐酸,根据溶液M中溶质不同,通过反应过程判断. ⑴当溶质为NaHCO3时,滴加盐酸与碳酸氢钠反应生成二氧化碳,立即产生气体,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为 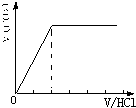 . .⑵若为NaHCO3、Na2CO3,不能立即产生气体,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积小于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为 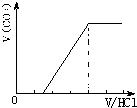 ⑶当溶质为Na2CO3时,不能立即产生气体,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积等于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为 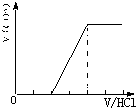 ; ;⑷若溶质为Na2CO3、NaOH时,不能立即产生气体,滴加盐酸先中和氢氧化钠,然后与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积同碳酸氢钠与盐酸反应生成二氧化碳所消耗的盐酸体积相等,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为 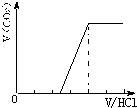 A、正确,如上分析⑴只有NHCO3⑶只有Na2CO3; B、正确;⑵为NaHCO3、Na2CO3,⑷溶质为Na2CO3、NaOH;C、不正确,溶质为NaHCO3和Na2CO3,二者的物质的量之比为2:1时,横坐标的起点为1,产生CO2结束时为4;D、正确,溶质为NaOH和Na2CO3,二者的物质的量之比为1:2,图象补充完整为:  。 。选C。 |
相似问题
把足量的稀硫酸分为质量相等的两份 倒入质量相等的甲 乙两个烧杯中 然后向甲杯中投入2.4 g镁 向乙
把足量的稀硫酸分为质量相等的两份,倒入质量相等的甲、乙两个烧杯中,然后向甲杯中投入2 4 g镁,向乙杯中小心地投入2 3 g钠,等反应停止后,称量两杯
(7分) 取一定量的Na2CO3 NaHCO3和Na2SO4混合物与250mL 1.00mol·L
(7分) 取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1 00mol·L-1过量盐酸反应生成2 016L CO2(标准状况),然后加入500mL 0 100mol·L-1
已知Na2SO4和NaCl混合溶液中 Cl-的物质的量浓度是Na+的物质的量浓度的倍 下列叙述中正确
已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的倍,下列叙述中正确的是( )A.Na2SO4和NaCl的物质的量之比为1 :3B.溶液中
将质量为1.15 g钠用刺了孔的铝箔包裹后放入水中 共收集到1.232 L(标准状况)气体。请回答下
将质量为1 15 g钠用刺了孔的铝箔包裹后放入水中,共收集到1 232 L(标准状况)气体。请回答下列问题:⑴(2分)1 15 g钠与水反应,理论上生成气体的体积(
下列有关Na2CO3和NaHCO3的说法 错误的是A.都易溶于水B.水溶液都显碱性C.都能与盐酸反应
下列有关Na2CO3和NaHCO3的说法,错误的是A.都易溶于水B.水溶液都显碱性C.都能与盐酸反应D.加热都能分解












