某无色溶液 其中有可能存在的离子如下:Na+ Ag+ Ba2+ Al3+ AlO -2 S2- CO
某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO
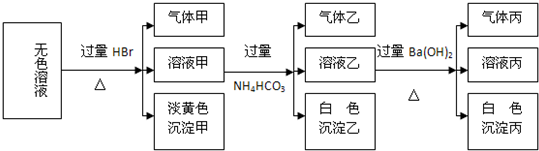 (1)沉淀甲是______,生成沉淀的离子方程式______. (2)沉淀乙是______,由溶液甲生成沉淀乙的离子方程式______. (3)沉淀丙是______. (4)综合上述信息,可以肯定存在的离子有______. |
参考解答
| 由无色溶液加HBr产生淡黄色沉淀,则沉淀甲为S,则发生2S2-+SO32-+6H+=3S↓+3H2O,一定存在S2-、SO32-;溶液甲与过量碳酸氢铵反应,则沉淀乙为Al(OH)3,气体乙为二氧化碳,溶液乙中加过量氢氧化钡反应生成白色沉淀丙应为BaCO3,气体丙为氨气,Ag+、Ba2+、Al3+与S2-、SO32-不能共存,则不存在,由电荷守恒可知,一定存在的阳离子为Na+,一定存在的阴离子为S2-、SO32-、AlO2-, (1)由上述分析可知,沉淀甲为S,生成沉淀的离子反应为2S2-+SO32-+6H+=3S↓+3H2O,故答案为:S;2S2-+SO32-+6H+=3S↓+3H2O; (2)沉淀乙为Al(OH)3,生成沉淀乙的离子反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al(OH)3;Al3++3HCO3-=Al(OH)3↓+3CO2↑; (3)原溶液中有可能有硫酸根离子,溶液乙中含碳酸氢根离子,则沉淀丙为BaCO3,可能有BaSO4,在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3 外还有BaSO4;若全部溶解,则仅有BaCO3, 故答案为:BaCO3,可能有BaSO4,在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3外还有BaSO4,若全部溶解,则仅有BaCO3; (4)肯定存在的离子有Na+、S2-、SO32-、AlO2-,故答案为:Na+、S2-、SO32-、AlO2-. |
相似问题
下列各组中两种物质在溶液的反应 能用同一离子方程式表示的是( )A.铁和稀盐酸 铁和稀硝酸B.铜和
下列各组中两种物质在溶液的反应,能用同一离子方程式表示的是( )A.铁和稀盐酸、铁和稀硝酸B.铜和浓硝酸、铜和稀硝酸C.NaHCO3+NaOH;NaHSO4+NaOH
某CuSO4 Fe2(SO4)3 H2SO4的混合溶液100mL 已知溶液中阳离子的浓度相同(不考虑
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol?L-1,则此溶液最多溶解铁粉的质
下列离子方程式中正确的是( )A.铜与热的浓硫酸:Cu+4H++SO42- △ . Cu2++
下列离子方程式中正确的是( )A.铜与热的浓硫酸:Cu+4H++SO42-△ Cu2++SO2↑+2H2OB.在碳酸氢铵稀溶液中加入足量的氢氧化钠稀溶液:NH4++OH-=NH3?H2
下列离子方程式错误的是( )A.钠投入硫酸铜溶液中:2Na+Cu2+═2Na++CuB.碳酸钙与盐
下列离子方程式错误的是( )A.钠投入硫酸铜溶液中:2Na+Cu2+═2Na++CuB.碳酸钙与盐酸反应:CaC03+2H+═Ca2++C02↑+H20C.硫酸与氯化钡反应:SO2-4+
下列文字表述及其对应的化学方程式或离子方程式都正确的是( )A.溴苯中滴入AgNO3溶液检验其中的
下列文字表述及其对应的化学方程式或离子方程式都正确的是( )A.溴苯中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓B.检验Fe3+存在:Fe3++3SCN












