(15 分) 亚氯酸钠(NaClO2)是一种重要的消毒剂 主要用于水 砂糖 油脂的漂白与杀菌。以下是
(15 分) 亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程: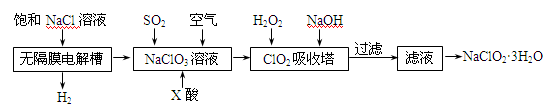 已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。 ②ClO2气体只能保持在稀释状态下以防止爆炸性分解,且需现合成现用。 ③ClO2气体在中性和碱性溶液中不能稳定存在。 (1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式: 。 (2)反应生成ClO2气体需要X酸酸化的原因为: 。X酸为 。 (3)吸收塔内的温度不能过高的原因为: (4)吸收塔内ClO2随着还原剂的不同和溶液酸碱性的变化可被还原为ClO2—或Cl—。ClO2被S2—还原为ClO2—、Cl—的转化率与溶液pH的关系如右图所示。 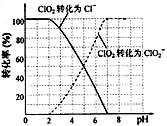 请写出pH≤2时ClO2与S2—反应的离子方程式: 。 (5)第二步向NaClO3溶液中通SO2的同时通入空气的原因为: 。 (6)从滤液中得到NaClO2·3H2O粗晶体的操作步骤为 、 、 。 |
参考解答
| (15 分) (1) Cl—+6e—+6OH—==ClO3—+3H2O(2分) (2) ClO2只能在酸性环境中存在。(2分) 硫酸。(2分) (3)防止H2O2分解(2分) (4) 2ClO2+5S2—+ 8H+ ==2Cl—+5S↓+4H2O (2分) (5)稀释ClO2气体,防止爆炸。(2分) (6)蒸发浓缩、冷却结晶、过滤。(3分) |
试题分析:(1)阳极上物质得到电子,故电极方程式为Cl—+6e—+6OH—==ClO3—+3H2O。 (2)ClO2气体在中性和碱性溶液中不能稳定存在,即ClO2气体只能在酸性环境中存在,酸为硫酸。 (3)温度不能过高的原因为防止H2O2分解。 (4)根据图中所示,pH≤2时,ClO2转化为Cl—,故离子方程式为2ClO2+5S2—+ 8H+ ==2Cl—+5S↓+4H2O。 (5)ClO2气体只能保持在稀释状态下以防止爆炸性分解,故通SO2的同时通入空气的原因为稀释ClO2气体,防止爆炸。 (6)晶体的析出一般步骤为蒸发浓缩、冷却结晶、过滤。注意条件的控制。 点评:本题是有关实验方案的设计和评价的考查,要求学生熟悉所实验的内容及原理,能够考查同学们进行分析问题、解决问题的能力。 |
相似问题
下列离子方程式书写正确的是A.Ba(OH)2溶液与过量的NaHCO3溶液混合Ba2++2OH-+2H
下列离子方程式书写正确的是A.Ba(OH)2溶液与过量的NaHCO3溶液混合Ba2++2OH-+2HCO3-BaCO3↓+CO32-+H2OB.次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-
有一工业废水 其中含有少量Fe2+ Ag+ Na+和SO42—。试设计一个实验方案 回收Ag并获得F
有一工业废水,其中含有少量Fe2+、Ag+、Na+和SO42—。试设计一个实验方案,回收Ag并获得FeSO4·7H2O。请填写下表。
下列离子方程式中正确的是 A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42—
下列离子方程式中正确的是 A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42—===BaSO4↓+H2OB.向NaHSO4溶液滴入NaHCO3溶液:HCO+HSO4-==CO2↑+
下列表示对应化学反应的离子方程式正确的是A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++F
下列表示对应化学反应的离子方程式正确的是A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+B.NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+C.醋酸溶液
下列反应的离子方程式正确的是( )A.氯气溶于水中 Cl2 +H2O = Cl― + ClO
下列反应的离子方程式正确的是()A.氯气溶于水中 Cl2 +H2O = Cl― + ClO― +2H+B.金属铁与稀硝酸反应 Fe + 2H+ = Fe2+ + H2↑C.在硅












