(8分)食盐中的抗结剂是亚铁氰化钾 其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[
(8分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。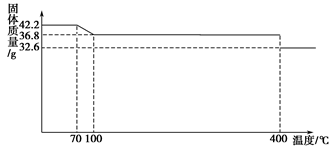 试回答下列问题: (1)试确定150 ℃时固体物质的化学式_____________。 (2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。 (3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为__________________________。 (4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_____________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全) |
参考解答
| (每空2分,下同,本题共8分)(1)K4[Fe(CN)6 (2)避免与醋等酸性物质一起烹饪;控制烹饪温度不超过400 ℃ (3)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ (4)c(Fe3+)= 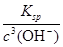 =1.1×10-3 mol·L-1>1×10-5 mol·L-1,故Fe3+没有沉淀完全 =1.1×10-3 mol·L-1>1×10-5 mol·L-1,故Fe3+没有沉淀完全 |
试题分析:(1)42.2 g K4[Fe(CN)6·3H2O物质的量=42.2g÷422g/mol=0.1mol,其中结晶水的物质的量是0.3mol,质量是0.3mol×18g/mol=5.4g。根据图像可知,反应进行到150℃时固体减少的质量是42.2g-36.8g=5.4g,这说明此时减少的质量就是结晶水的质量,因此固体的化学式为K4[Fe(CN)6。 (2)由于亚铁氰化钾水溶液与酸反应放出极毒的氰化氢(HCN)气体,且亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN),所以在使用时应该注意避免与醋等酸性物质一起烹饪;控制烹饪温度不超过400 ℃。 (3)由于在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化,则根据方程式4Fe2++O2+4H+=4Fe3++2H2O可知,前者减去后者即得到另一个反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。 (4)当溶液pH为3时,则溶液中OH-浓度是10-11mol/L,则此时溶液中c(Fe3+)= 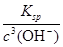 =1.1×10-3 mol·L-1>1×10-5 mol·L-1,故Fe3+没有沉淀完全。 =1.1×10-3 mol·L-1>1×10-5 mol·L-1,故Fe3+没有沉淀完全。 |
相似问题
下列离子方程式书写正确的是A.向海带灰浸出液中加入硫酸 双氧水:2I-+2H++H2O2I2+2H2
下列离子方程式书写正确的是A.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2I2+2H2OB.Cu片插入FeCl3溶液中:Cu+Fe3+ Fe2++Cu2+C.向Al2(SO4)3
下列表示对应化学反应的离子方程式正确的是( )A.NH4HCO3溶液与过量KOH浓溶液共热:NH4+
下列表示对应化学反应的离子方程式正确的是()A.NH4HCO3溶液与过量KOH浓溶液共热:NH4+ + OH- NH3↑+ H2OB.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好
下列离子方程式书写正确的是A.铁溶于盐酸中 2Fe + 6H+ = 2Fe3+ + 3H2↑B.碳酸
下列离子方程式书写正确的是A.铁溶于盐酸中 2Fe + 6H+ = 2Fe3+ + 3H2↑B.碳酸钠与硫酸溶液反应 CO32ˉ + H+ = CO2↑+ H2OC.二氧化硫被烧
下列反应的离子方程式不正确的是A.向NH4HCO3溶液中加入过量烧碱溶液:NH4+ +OH-= NH
下列反应的离子方程式不正确的是A.向NH4HCO3溶液中加入过量烧碱溶液:NH4+ +OH-= NH3↑+H2OB.将CO2通入到纯碱饱和溶液中:2Na++CO32-+CO2+H2O=
下列离子方程式书写正确的是A.在Fe(OH)3胶体中加入HI溶液:Fe(OH)3 +3H+=Fe3+
下列离子方程式书写正确的是A.在Fe(OH)3胶体中加入HI溶液:Fe(OH)3 +3H+=Fe3+ +3H2OB.在稀氨水中通入少量SO2:NH3?H2O+SO2=NH4++HSO3-C.向澄清石灰












