(16分)实验室中以粗铜(含杂质)为原料 某种制备铜的氯化物的流程如下:按要求回答下列问题:(1)操
(16分)实验室中以粗铜(含杂质)为原料,某种制备铜的氯化物的流程如下: 按要求回答下列问题: (1)操作①的所用到的玻璃仪器有______________。 (2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是 ; 溶液1可加试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)___________。 A.NaOH B.NH3·H2O C.CuO D.CuSO4 (3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出 制备CuCl的离子方程式: 。 (4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。 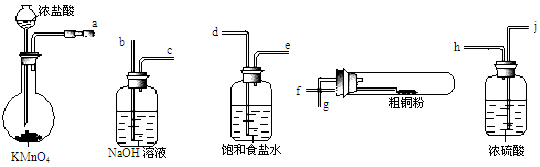 ①按气流方向连接各仪器接口顺序是:a→ 、 → 、 → 、 → 。实验中大试管加热前要进行一步重要操作,其操作是 。 ②反应时,盛粗铜粉的试管中的现象是 。 (5)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。已知:氯化铜溶液中有如下转化关系: Cu(H2O)42+(aq) + 4Cl-(aq)  CuCl42-(aq) + 4 H2O (l) CuCl42-(aq) + 4 H2O (l)蓝色 绿色 该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 (填序号)。 A.将Y稀释,发现溶液呈蓝色 B.在Y中加入CuCl2晶体,溶液变为绿色 C.在Y中加入NaCl固体,溶液变为绿色 D.取Y进行电解,溶液颜色最终消失 |
参考解答
| (1)漏斗、烧杯、玻璃棒;(2)抑制氯化铜、氯化铁水解;C D; (3)SO2+2H2O+2Cu2++2Cl-=2CuCl+SO42-+4H+; (4)①dehifgb;通入一段时间的氯气,将装置中的空气排尽;②产生大量棕黄色的烟;(5)ABC |
试题分析:(1)操作①是过滤。所用到的玻璃仪器有漏斗、烧杯、玻璃棒;(2)Cu与Cl2反应得到CuCl2,杂质也与氯气反应得到金属氯化物。CuCl2是强酸弱碱盐,容易水解,为了抑制氯化铜、氯化铁水解溶解固体在稀盐酸的环境中。溶液1的主要成分是CuCl2,若加试剂X用于调节pH以除去杂质, X应该是含有Cu2+的物质。选项为CD。(3)根据题意结合电子守恒、电荷守恒及原子守恒可得方程式:SO2+2H2O+2Cu2++2Cl-=2CuCl+SO42-+4H+;(4)①要经过制取气体、除去杂质、气体干燥、发生反应、尾气处理等实验步骤。按气流方向连接各仪器接口顺序是:a→d→e→h→i→f→g→b。实验中大试管加热前要进行一步重要操作,其操作是通入一段时间的氯气,将装置中的空气排尽再进行实验,否则Cu会被氧化为CuO;②在大试管发生反应:Cu+ Cl2  CuCl2,盛粗铜粉的试管中的现象是产生大量棕黄色的烟;(5)A.将Y稀释,即加入水,若存在上述平衡,则增大了水的浓度,平衡逆向移动,产生更多的蓝色的Cu(H2O)42+(aq)。正确。 B.在Y中加入CuCl2晶体,即增大了c(Cl-)的浓度,平衡正向移动,绿色的CuCl42-(aq)的浓度增大。溶液变为绿色。正确。C.在Y中加入NaCl固体,c(Cl-)的浓度增大,平衡正向移动,绿色的CuCl42-(aq)的浓度增大,溶液变为绿色。正确。D.取Y进行电解,溶液颜色最终消失,这与是哪种结合方式无关。错误。 CuCl2,盛粗铜粉的试管中的现象是产生大量棕黄色的烟;(5)A.将Y稀释,即加入水,若存在上述平衡,则增大了水的浓度,平衡逆向移动,产生更多的蓝色的Cu(H2O)42+(aq)。正确。 B.在Y中加入CuCl2晶体,即增大了c(Cl-)的浓度,平衡正向移动,绿色的CuCl42-(aq)的浓度增大。溶液变为绿色。正确。C.在Y中加入NaCl固体,c(Cl-)的浓度增大,平衡正向移动,绿色的CuCl42-(aq)的浓度增大,溶液变为绿色。正确。D.取Y进行电解,溶液颜色最终消失,这与是哪种结合方式无关。错误。 |
相似问题
对于数以千万计的化学物质和为数更多的化学反应 分类法的作用几乎是无可替代的。 (1)现有下列五种物质
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。 (1)现有下列五种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2。按照不同
(8分)含硫化合物的种类很多 现有H2SO4 H2SO3 SO2 Na2SO3 BaSO4 CuSO
(8分)含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:(1)写出硫元素在周期表中
下列说法及对应化学方程式或离子方程式正确的是A.84消毒液与洁厕灵混合可能产生毒气: ClO- +
下列说法及对应化学方程式或离子方程式正确的是A.84消毒液与洁厕灵混合可能产生毒气: ClO- + Cl- + 2H+ = Cl2↑ + H2OB.用二氧化硅和水反应
下列反应属于氧化还原反应的是[ ]A MnO2+4HCl==MnCl2+Cl2↑ + 2H2
下列反应属于氧化还原反应的是[ ]A、MnO2+4HCl==MnCl2+Cl2↑ + 2H2OB、CaO+H2O==Ca(OH)2 C、2H2O22H2O+O2↑D、CaCO3CaO+CO2↑
下列变化与氧化还原反应无关的是 [ ]A.钢铁冶炼B.燃料燃烧C.酸碱中和D.食物腐败
下列变化与氧化还原反应无关的是 [ ]A 钢铁冶炼B 燃料燃烧C 酸碱中和D 食物腐败












