A B C D E F为原子序数依次增大的六种元素 其中除F外均为短周期主族元素.常温下A B C的
| A、B、C、D、E、F为原子序数依次增大的六种元素,其中除F外均为短周期主族元素.常温下A、B、C的常见单质均为无色、无味的气体,D、E、F的单质均为固体,且F单质是目前世界上使用量最大的金属.A是所有元素中原子半径最小的元素,C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个.请用化学用语回答下列问题: (1)C的离子结构示意图为______;D与E两元素的离子半径:D______E(填“>”、“<”或“=”). (2)由A与碳元素组成的原子个数比3:1的最简化合物的结构简式为______. (3)A与C形成的10电子阴离子与A与E形成的18电子阴离子反应的离子方程式为______. (4)B的最高价氧化物的水化物与其氢化物反应生成的盐的水溶液的PH______7(填“>”、“<”或“=”).化合物AB3是一种无色的液态物质,受撞击会分解成两种单质,请写出该反应的化学方程式______. (5)已知一定条件下,D单质与氧化物F3O4反应时,放出大量的热且使F单质熔化.试写出该反应的化学方程式______. (6)上述元素中的五种元素可形成一种复盐,三种离子个数比为1:1:2,若向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解;同时有刺激性气味的气体放出;若加入盐酸酸化的BaCl2溶液,也有白色沉淀产生.则该复盐的化学式为______. |
参考解答
| 常温下A、B、C的单质均为无色、无味的气体,常见单质均为无色无味的气体有H2、N2、O2;F单质是目前世界上使用量最大的金属,说明F为铁;A是所有元素中原子半径最小的元素,说明A是氢元素;C与E同主族,且E的原子序数为C的2倍,在主族中只有氧和硫,氧的原子序数为8,硫的原子序数为16;D的最外层电子数比最内层多1个,A、B、C、D、E、F为原子序数依次增大的六种元素,C为氧,说明D在第三周期,则D原子的核外有三个电子层,第一电子层排2个电子,最外层即第三层应排3个电子,则核外电子数为13,即为铝.故A为H、B为N、C为O、D为Al、E为S、F为Fe. (1)氧原子最外层排布6个电子,得到两个电子后形成O2-,O2-离子结构示意图为 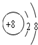 .微粒半径大小比较看电子层数,电子层数越多,半径越大,D离子是Al3+与E离子是S2-,Al3+离子结构示意图为 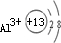 ,S2-离子结构示意图为 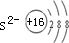 ,Al3+核外2个电子层,S2-核外3个电子层,故离子半径:Al3+<S2-, 故答案为: 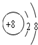 ;<; (2)A是氢元素,由H与碳元素组成的原子个数比3:1的化合物的最简式为CH3,再结合烷烃通式:CnH2n+2分析: 设该化合物的分子式为(CH3)n,n=1,分子式为CH3,不符合烷烃通式;n=2,分子式为C2H6,为乙烷,符合烷烃通式;n=3,分子式为C3H9,不符合烷烃通式;故可确定该化合物为乙烷C2H6,结构简式为CH3-CH3. 故答案为:CH3-CH3; (3)H与O形成的10电子阴离子是OH-,H与S形成的18电子阴离子是HS-,HS-是酸式根离子,可与OH-反应,反应的离子方程式为HS-+OH-═S2-+H2O, 故答案为:HS-+OH-═S2-+H2O; (4)B是N元素,氮的最高价氧化物的水化物是HNO3,氮的氢化物是NH3,HNO3与NH3反应生成的盐是NH4NO3,为强酸弱碱盐.根据盐类水解原理解题,强酸弱碱盐水解呈酸性,所以NH4NO3水溶液呈酸性,pH<7. 化合物AB3是HN3,根据题意,受撞击会分解成两种单质,只能是H2和N2.根据反应物和生成物写出方程式再配平即得2HN3═H2↑+3N2↑, 故答案为:<;2HN3=H2↑+3N2↑; (5)D单质是Al,与氧化物F3O4反应时,放出大量的热且使Fe单质熔化,该反应为铝热反应,根据反应物和生成物写出方程式再配平即得8Al+3Fe3O4
故答案为:8Al+3Fe3O4
(6)复盐指由两种阳离子和一种酸根离子组成的盐,向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解,说明含有Al3+,反应为Al3++3OH-═Al(OH)3↓、 Al(OH)3+OH-═AlO2-+2H2O.同时有刺激性气味的气体放出,说明含有NH4+,反应为NH4++OH-═NH3?H2O.加入盐酸酸化的BaCl2溶液,也有白色沉淀产生,说明酸根离子是SO42-,反应为 SO42-+Ba2+═BaSO4↓.故该复盐中含NH4+、Al3+、SO42-.根据三种离子个数比为1:1:2,结合化合价代数和等于零即可确定该复盐的化学式为NH4Al(SO4)2, 故答案为:NH4Al(SO4)2. |
相似问题
下列离子方程式中正确的是( )A.稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑B.稀硫酸与氢氧
下列离子方程式中正确的是( )A.稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑B.稀硫酸与氢氧化钡溶液混合:H++SO2-4+Ba2++OH-═BaSO4↓+H2OC.硝酸滴在石
(1)将AgNO3溶液分别与HCl NaCl KCl溶液混合 均有______产生 它们的离子反应方
(1)将AgNO3溶液分别与HCl、NaCl、KCl溶液混合,均有______产生,它们的离子反应方程式______.(2)锌粒投入稀硫酸中,溶液里______离子的量减少,____
A B C D E 5瓶透明溶液 分别是HCl BaCl2 NaHSO4 Na2CO3和AgNO3中
A、B、C、D、E5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种.已知:①、A与B反应有气体生成;②、B与C反应有沉淀生成;③、C与D反应有
下列离子方程式不正确的是( )A.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑B.金属
下列离子方程式不正确的是( )A.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑B.金属铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑C.氢氧化钡与硫酸反应:Ba2++2OH
下列离子方程式的书写正确的是( )A.氢氧化钡溶液与等物质的量的稀硫酸混合:Ba2++2OH-+2
下列离子方程式的书写正确的是( )A.氢氧化钡溶液与等物质的量的稀硫酸混合:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2OB.玻璃试剂瓶被烧碱溶液腐蚀:SiO2












