某化学实验小组为验证常见还原剂SO2 I- Fe2+的还原性强弱的顺序为:SO2>I->Fe2+ 用
某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为:SO2>I->Fe2+,用下图所示装置进行实验(加热和夹持装置已略,气密性已检验).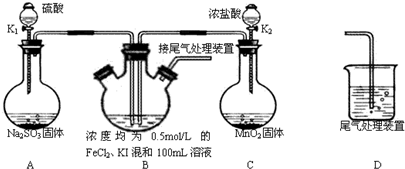 (1)上述实验需要加热的装置是______ (2)D中,烧杯盛放的是______ (3)实验开始时,关闭K1,打开K2,通入少量氯气,写出B中发生反应的离子方程式______ ①为验证I-的还原性比Fe2+强,取(3)后B中的少量溶液于试管中,应再往试管中滴入______溶液,现象是______ ②在(3)后,为了比较SO2和I-的还原性强弱,接下来的操作是______ A.关闭K2开K1 B.关闭K1打开K2 C.同时打开K1和K2 (4)若打开K2,通入Cl2恰好将Fe2+、I-全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为______. |
参考解答
| (1)二氧化锰和浓盐酸在加热的条件下会发生反应生成氯气,所以加热的仪器是C,故答案为:C; (2)氯气属于有毒气体,可以用氢氧化钠溶液来吸收,所以D中烧杯盛放的是氢氧化钠溶液,故答案为:氢氧化钠溶液(NaOH溶液); (3)亚铁离子和碘离子具有还原性,能被氯气氧化,但是碘离子的还原性强于亚铁离子,所以少量的氯气可以将碘离子氧化,但是不能将亚铁离子氧化, 故答案为:2I-+Cl2═I2+2Cl-; ①碘离子可以被氧化为单质碘,碘单质遇到淀粉变为蓝色,据此可以用淀粉检验碘单质的产生,故答案为:淀粉溶液;溶液呈蓝色; ②比较SO2和I-的还原性强弱,可以根据二氧化硫能否和碘单质间的反应来判断,所以可以关闭K2开K1,故答案为:A; (4)铁离子和二氧化硫之间的反应实质是:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,根据铁元素守恒,铁离子的物质的量是0.05mol,所以消耗二氧化硫的物质的量是0.025mol,体积是:0.025mol×22.4L/mol=0.56L,故答案为:0.56L. |
相似问题
某溶液中含有Cl-和I-的物质的量浓度相同。为了氧化I-而不使Cl-氧化 试根据下列三个反应判断 可
某溶液中含有Cl-和I-的物质的量浓度相同。为了氧化I-而不使Cl-氧化,试根据下列三个反应判断,可选用的氧化剂是:①2Fe3++2I-=2Fe2++I2②2Fe2++Cl2=2Fe
根据下列三个反应 判断物质的氧化性由强到弱的顺序正确的是①2Fe3++2I-=2Fe2++I2
根据下列三个反应,判断物质的氧化性由强到弱的顺序正确的是①2Fe3++2I-=2Fe2++I2②2Fe2++C12=2Fe3++2C1-③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2OA.Fe3+>
已知氧化性顺序是:Cl2﹥Br2﹥Fe3+﹥I2 在FeI2和FeBr2混合溶液中 通入一定量Cl2
已知氧化性顺序是:Cl2﹥Br2﹥Fe3+﹥I2,在FeI2和FeBr2混合溶液中,通入一定量Cl2,溶液中存在的离子组不合理的是( )A.Fe3+ Br- Cl-B.Fe2+ Br-
下列反应中 HCl既表现出酸性又表现出还原性的是通电 A.Zn + 2HCl ='' ZnCl2 +
下列反应中,HCl既表现出酸性又表现出还原性的是通电A.Zn + 2HCl = " " ZnCl2 + H2↑△B.2HCl = "=== " H2 ↑+ Cl2↑C.MnO2 + 4HCl = "=== " MnCl2 + Cl2 ↑ + 2H2OD.HCl + AgNO3 = "== " AgCl ↓ + HNO3
氮化硅(Si3N4)是一种新型陶瓷材料 它可由石英与焦炭在高温的氮气流中 通过以下反应制得:3SiO
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2Si3N4+6CO。下列对该反应的说法正确的是A.该反












