I. 今有H2 Cl2混合气100 mL(标况) 其中一种气体的体积为45mL。光照使两种气体发生反
| I. 今有H2、Cl2混合气100 mL(标况),其中一种气体的体积为45mL。光照使两种气体发生反应后恢复到标况,气体体积为 mL。为了说明反应后气体中H2或Cl2有剩余,使气体通过10 mL水,并使剩余气体干燥后恢复到标况, (1)若仍剩余___mL,证明有___剩余,理由是_____; (2)若溶液有___性质,证明有___剩余,理由是________________________。 II.一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图所示)。 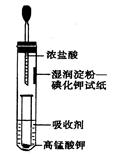 (1)下列溶液能吸收Cl2的是________。
(3)实验室制取氯气的离子方程式__________________________。 |
参考解答
| Ⅰ、100(2分) (1)10;H2;H2不溶于水 (2)漂白;Cl2;Cl2溶于水后生成有漂白性的HClO (每空1分) Ⅱ、(每空2分)(1)C (2)湿润淀粉—碘化钾试纸变蓝 (3)MnO2+4H++2Cl-  Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
试题分析:Ⅰ氯气与氢气的反应是反应前后气体体积无变化的反应,所以反应后气体体积仍为100ml, (1)若余10ml气体则余氢气,因为氢气不溶于水; (2)若溶液有漂白性,则证明氯气有剩余,因为氯气溶于水有次氯酸生成,次氯酸具有漂白性。 Ⅱ(1)氯气溶于水后溶液显酸性,因此应用碱性溶液吸收,选C; (2)湿润淀粉—碘化钾试纸变蓝说明氯气能置换出碘,从而能说明Cl2的氧化性强于I2; (3)实验室中用浓盐酸与二氧化锰共热制氯气,其离子方程式为:MnO2+4H++2Cl-  Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
相似问题
硫酸铵在加强热条件下分解 生成氨 二氧化硫 氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是
硫酸铵在加强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是 [ ]A.1:3B.2:3 C.1:1 D.4:3
下列叙述正确的是[ ]A.含非金属元素的离子只能是阴离子 B.某元素从化合态变为游离态时一定
下列叙述正确的是[ ]A.含非金属元素的离子只能是阴离子 B.某元素从化合态变为游离态时一定是被还原 C.在氧化还原反应中,非金属单质一定是氧化剂
在下列反应中 硫酸只表现出强氧化性的反应是[ ]A.C与浓H2SO4反应B.Cu与浓H2SO
在下列反应中,硫酸只表现出强氧化性的反应是[ ]A.C与浓H2SO4反应B.Cu与浓H2SO4反应C.CuO与H2SO4反应D.Mg(OH)2与H2SO4反应
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3===2HNO3+4N2+9H2O 在反应中被
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3===2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为 [ ]A.5∶3 B.5∶4C.1∶1D.3∶5
下列反应中必须加入还原剂才能进行的是[ ]A.Cl-→Cl2 B.Zn→ Zn2+ C.H
下列反应中必须加入还原剂才能进行的是[ ]A.Cl-→Cl2 B.Zn→ Zn2+ C.H2→H2O D.CuO→Cu












