2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中 在一定条件下发生下述反应:
2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)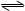 PCl5(g),达平衡时,PCl5为0.40 mol,如果此时再加入1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是 PCl5(g),达平衡时,PCl5为0.40 mol,如果此时再加入1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
|
参考解答
| B |
| 考查化学平衡的移动及等效平衡 依据所给信息可知,当平衡时再加入1.0 mol PCl3和0.50 mol Cl2时,相当于另一个初始状态:3.0 mol PCl3和1.5 mol Cl2充入体积不变的密闭容器中; 我们可以这样理解:该初始状态的容器体积为1.5倍的原容器体积,那么平衡时,PCl5的物质的量一定为0.40×1.5='0.60' mol,再压缩至原容器体积,平衡正向移动,PCl5的物质的量增大,必定大于0.60 mol |
相似问题
在一个固定体积的密闭容器中 向容器中充入2 mol A 和1 mol B 发生如下反应:2A(g)
在一个固定体积的密闭容器中,向容器中充入2 mol A 和1 mol B,发生如下反应:2A(g) + B(g) 2C(g) + D(g),达到平衡时C的浓度为0 4 mol·L-
2.0molPCl3和1.0molCl2充入体积不变的密闭容器中 在一定条件下发生下述反应:PCl3
2 0molPCl3和1 0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g);反应达到平衡时,PCl5为0 4mol;如果此时移
(16分)为解决大气中CO2的含量增大的问题 某科学家提出“绿色自由”构想:把工厂排出的富含CO2的
(16分)为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提
对于达到平衡的可逆反应:X+Y W+Z 增大压强则正 逆反应速率(v)的变化如图所示 分析可知X Y
对于达到平衡的可逆反应:X+Y W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是A.Z、W为气体,X、Y中之一为气
在可逆反应2A(g) + B(g)2C(g) △H<0中 为了有利于A的利用 应采用的反应条件是
在可逆反应2A(g) + B(g)2C(g) △H<0中,为了有利于A的利用,应采用的反应条件是()A.高温、高压B.高温、低压C.低温、低压D.适当温度、高压












