(12分)已知:I2+2S2O===S4O+2I-。相关物质的溶度积常数见下表:物质Cu(OH)2F
(12分)已知:I2+2S2O===S4O+2I-。相关物质的溶度积常数见下表:
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是 (用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 。 (3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。 ①可选用 作滴定指示剂,滴定终点的现象是 。 ②CuCl2溶液与KI反应的离子方程式为 。 ③该试样中CuCl2·2H2O的质量百分数为 。 |
参考解答
| (12分)(1) CuO或Cu(OH)2或 CuCO3或Cu2(OH)2CO3(1分)2.6×10-9 mol·L-1(2分) (2)2CuCl2·2H2O 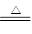 Cu(OH)2·CuCl2+2HCl+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可 (2分) 在干燥的HCl气流中加热脱水(1分) Cu(OH)2·CuCl2+2HCl+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可 (2分) 在干燥的HCl气流中加热脱水(1分)(3) ①淀粉溶液(1分) 蓝色褪去,放置一定时间后不复色(1分) ②2Cu2++4I-===2CuI↓+I2 (2分) ③95%(2分) |
试题分析:(1)由于在除杂的过程中不能引入新的杂质,所以要调节溶液的酸碱性,使氢氧化铁析出,而得到纯净的氯化铜晶体,则应该加入氧化铜或氢氧化铜。根据氢氧化铁的溶度积常数可知,当溶液的pH=4时,溶液中铁离子的浓度应该是 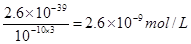 。 。(2)由于氯化铜在溶液中存在铜离子的水解平衡,而加热促进水解,且生成的氯化氢极易挥发,进一步促进水解,因此得不到氯化铜晶体,反应的化学方程式使是2CuCl2·2H2O 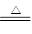 Cu(OH)2·CuCl2+2HCl+2H2O;因此由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水。 Cu(OH)2·CuCl2+2HCl+2H2O;因此由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水。(3)①由于碘离子被氧化生成了单质碘,而碘遇淀粉显蓝色,所以选择的指示剂是淀粉溶液。Na2S2O3将单质碘还原生成了碘离子,所以终点时的反应现象是蓝色褪去,放置一定时间后不复色。 ②氯化铜能把碘化钾氧化生成单质碘,所以CuCl2溶液与KI反应的离子方程式是2Cu2++4I-===2CuI↓+I2。 ③根据有关的反应方程式可知2CuCl2·2H2O~I2~2Na2S2O3,所以氯化铜晶体的物质的量是0.02L×0.1000mol/L=0.002mol,则试样中CuCl2·2H2O的质量百分数为 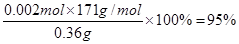 。 。点评:本题是高考中的常见题型,属于难度较大的试题,考查的知识点比较多。这类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。本题有利于培养学生的逻辑推理能力,以及分析问题、解决问题的能力。 |
相似问题
小华家中有如下生活用品:碘酒 食盐 食醋 漂白粉 小华利用上述用品不能完成的任务是( )A.检验买
小华家中有如下生活用品:碘酒、食盐、食醋、漂白粉,小华利用上述用品不能完成的任务是()A.检验买来的奶粉中是否加有淀粉B.检验自来水中是否含有Cl
工业上制备纯净的氯化锌时 将含杂质的氯化锌溶于过量的盐酸中 为了除去杂质需要调节溶液的pH到4 应加
工业上制备纯净的氯化锌时,将含杂质的氯化锌溶于过量的盐酸中,为了除去杂质需要调节溶液的pH到4,应加入的试剂是A.氢氧化钠 B.氨水C.氧化锌D.氯化锌
欲用96%的工业酒精制取无水乙醇时 可选用的方法是 ( )A.加入
欲用96%的工业酒精制取无水乙醇时,可选用的方法是()A.加入无水CuSO4,再过滤B.加入生石灰,再蒸馏C.加入浓硫酸,再加热,蒸出乙醇D.将96%的乙醇溶
实验室里由粗盐制备精盐的实验中 必需的操作步骤有A.溶解B.过滤C.分液D.蒸发浓缩
实验室里由粗盐制备精盐的实验中,必需的操作步骤有A.溶解B.过滤C.分液D.蒸发浓缩
若从溴水中把溴萃取出来 可选用的萃取剂是( )A.水B.无水酒精C.四氯化碳D.氢氧化钠溶液
若从溴水中把溴萃取出来,可选用的萃取剂是( )A.水B.无水酒精C.四氯化碳D.氢氧化钠溶液












