由人尿分离出来的结晶化合物A 熔点为187~188℃。对化合物A作如下实验:(1)测得A的蒸气密度为
| 由人尿分离出来的结晶化合物A,熔点为187~188℃。对化合物A作如下实验: (1)测得A的蒸气密度为8.0g/L(已折合成标准状况)。取17.92g A完全燃烧,生成的气体通过浓H2SO4,使浓 H2SO4增重8.10g。剩余气体通过碱石灰,气体质量减轻39.60g,另取17.92gA完全分解,可得1.12L(标况) 氮气。试通过计算确定A的化学式。 (2)又已知A和足量6mol/L的盐酸混合加热可以完全水解,1molA水解生成1molB和1molC。已知:A、B、 C三种物质的分子中均含有一个羧基;B物质仅由C、H、O三种元素组成,其物质的量之比7:6:2;C的 俗名为甘氨酸。写出A、B、C的结构简式:A________ ;B_________ ;C_________。 |
参考解答
| (1)M(A)=8.0g/LX22.4L·mol-1=179.2g·mol-1 n(A)=17.92g/179.2g·mol-1=0.10mol n(N2)=1.12L/22.4L·mol-1=0.05mol n(CO2)=39.6g/44g·mol-1=0.90mol n(H2O)=8.1g/18g·mol-1=0.45mol ∴1mol A中含9molC原子,9mol H原子,1mol N 原子。 O的物质的量(179.2-9×12-9×1-1×14)g/16g·mol-1=3mol。 ∴A的化学式为C9H9O3N。 (2)A: 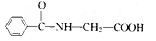 B: B: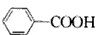 C: C: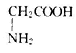 |
相似问题
我国有部分城市已开始使用乙醇汽油 目前工业制乙醇的主要方法为:石油乙烯乙醇。某制糖厂以甘蔗为原料制得
我国有部分城市已开始使用乙醇汽油,目前工业制乙醇的主要方法为:石油乙烯乙醇。某制糖厂以甘蔗为原料制得蔗糖,并对甘蔗渣进行综合处理制得乙醇,主要
将0.2mol两种气态烃组成的混合气完全燃烧后得到6.72升二氧化碳(标准状况下)和7.2克水 下
将0 2mol两种气态烃组成的混合气完全燃烧后得到6 72升二氧化碳(标准状况下)和7 2克水, 下列说法正确的是 [ ]A.一定有乙烯 B.一定有甲烷 C.一定没
A B两种有机物的蒸气对氢气的相对密度均为54 各取 5.4g使之完全燃烧 只生成CO2和H2O 并
A、B两种有机物的蒸气对氢气的相对密度均为54,各取 5 4g使之完全燃烧,只生成CO2和H2O,并分别用氧气约为 9 52L(标准状况),将燃烧产物通人足量石
有机物A和B的分子量都小于200 完全燃烧时只生成CO2 和H2O B燃烧时消耗的氧气与生成的二氧化
有机物A和B的分子量都小于200,完全燃烧时只生成CO2 和H2O,B燃烧时消耗的氧气与生成的二氧化碳的物质的量相等,B中碳、氢元素总的质量分数为46 67%,B
工业上生产“的确良”通常用乙二醇 对苯二甲酸为原料 反应式为:nHOCH2CH2OH+→ +(2n-
工业上生产“的确良”通常用乙二醇、对苯二甲酸为原料,反应式为:nHOCH2CH2OH+→ +(2n-1)H2O,合成时,若消耗乙二醇的物质的量比对苯二甲酸多5‰,上述












