根据下表数据回答问题:温度(℃)01020406080100NaOH溶解度(g/100g水)4251
根据下表数据回答问题:
(2)在装有100g NaOH固体的小烧杯中,加入100g冰水并充分溶解后测定溶液温度为10℃,此时所得溶液为______(选填“饱和”或“不饱和”)溶液.再将该烧杯放入盛有热水的大烧杯中,使溶液温度升至60℃,此时溶液中溶质与溶剂的质量比为______. (3)利用用(2)中所得溶液进行如下实验: 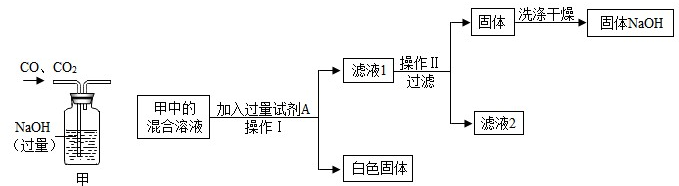 ①加入试剂A时发生反应的化学方程式为______; ②滤液1中含有的溶质是______; 操作Ⅱ的名称是______. |
参考解答
| (1)分析表中数据大小的变化即可知氢氧化钠的溶解度随温度升高而增大(或氢氧化钠的溶解度受温度影响变化大); (2)根据10℃氢氧化钠的溶解度是51g所以100g NaOH固体的小烧杯中,加入100g冰水并充分溶解后(氢氧化钠溶于水放热冰溶解)能溶解的氢氧化钠时51g,固体氢氧化钠有剩余,所以此时溶液饱和,60℃时氢氧化钠的溶解度174g,此时剩余的氢氧化钠能完全溶解,溶质是100g溶剂也是100g,溶液不饱和; (3)一氧化碳与二氧化碳通过过量的氢氧化钠溶液时,二氧化碳能与氢氧化钠反应生成碳酸钠和水,所以该溶液为氢氧化钠和碳酸钠的混合溶液,由图示的过程可知最终是制得纯净的氢氧化钠,所以考虑A是氢氧化钙,加入过量的氢氧化钙即可得碳酸钙与氢氧化钠的溶液,此时滤液I中含有的溶质是氢氧化钠和剩余的氢氧化钙,由于氢氧化钠的溶解度随温度升高而增大氢氧化钙的溶解度随温度的升高而降低,所以可采用降温的方式提纯氢氧化钠,使其从溶液中结晶析出; 故答案为:(1)氢氧化钠的溶解度随温度升高而增大(或氢氧化钠的溶解度受温度影响变化大); (2)饱和;1:1; (3)①Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;②NaOH和Ca(OH)2;冷却(或降温结晶); |
相似问题
如图是A B C三种固体物质的溶解度曲线 请回答:(1)曲线中P点表示______.(2)A物质中混
如图是A、B、C三种固体物质的溶解度曲线,请回答:(1)曲线中P点表示______.(2)A物质中混有少量B物质时,可采用______的方法得到较纯净的A物质.(3
如图是X Y两种物质的溶解度曲线:(1)______℃时 X与Y的溶解度相等.(2)t2℃时 X Y
如图是X、Y两种物质的溶解度曲线:(1)______℃时,X与Y的溶解度相等.(2)t2℃时,X、Y两种物质饱和溶液的质量分数比较______(用“=”、“<”、“>
如图为A B C三种固体物质的溶解度随温度变化的曲线图.请回答下列问题:(1)40℃时 A B C三
如图为A、B、C三种固体物质的溶解度随温度变化的曲线图.请回答下列问题:(1)40℃时,A、B、C三种物质的溶解度由小到大的顺序是______;请通过比较A、B
如图是A B两种固体物质的溶解度曲线图 下列说法不正确的是( )A.P点表示t1℃时 A B两物质
如图是A、B两种固体物质的溶解度曲线图,下列说法不正确的是( )A.P点表示t1℃时,A、B两物质的溶解度相等B.在其他条件不变的情况下,若把t1℃时A
如图是a b c三种固体物质的溶解度曲线图.(1)t3℃时 a b c三种物质的溶解度由大到小的顺序
如图是a、b、c三种固体物质的溶解度曲线图.(1)t3℃时,a、b、c三种物质的溶解度由大到小的顺序是______.(2)将t1℃时一定质量c饱和溶液升温t2℃(不












