化学键的键能是指气态原子间形成1mol化学键时释放的能量。如H(g)+I(g)→H-I(g) △H
| 化学键的键能是指气态原子间形成1mol化学键时释放的能量。如H(g)+I(g)→H-I(g) △H =+297kJ/mol即H-I键的键能为297kJ.mol-1,也可以理解为破坏1mol H-I键需要吸收297kJ的热量。一个化学反应一般都有旧化学键的破坏和新化学键的形成。下表是一些键能数据(kJ.mol-1): |
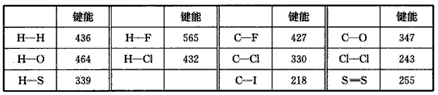 |
| (1)由表中数据能否得出这样的结论: ①半径越小的原子形成的共价键越牢固(即键能越大)____(填“能”或“不能”)。 ②非金属性越强的原子形成的共价键越牢固____(填“能”或“不能”)。 请从所给数据找出一些规律,并写出其中一条:____;试预测C-Br键的键能范围 ____kJ·mol-1<C-Br键能<___kJ·mol-1。 (2)由热化学方程式H2 (g)+Cl2 (g)=2HCl(g) △H= -185kJ·mol-1,并结合上表数据可推知一个化学反应的反应热(设反应物、生成物均为气态)与反应物和生成物的键能之间的关系是____。 由热化学方程式 2H2 (g)+S2 (s)=2H2S(g) △H= -224. skJ·mol-1和表中数值可计算出1mol S2 (s)气化时将____(填“吸收”或“放出”)____kJ的热量。 |
参考解答
| (1)①不能;②不能;与相同原子结合时,同主族元素形成的共价键,原子半径越小,共价键越强; 218;330 (2)化学反应的反应热等于生成物的键能之和与反应物的键能之和的差值; 吸收; 4.5 |
相似问题
已知1 g氢气完全燃烧生成水蒸气时放出热量121kJ 且氧气中1 mol O=O键完全断裂时吸收热量
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键
已知在相同状况下 同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。下列说法错误的是 [
已知在相同状况下,同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。下列说法错误的是 [ ]A.电解熔融的Al2O3可以制得金属铝和氧气,该反应
据报道 科学家已成功合成了少量O4(其结构式是) 有关O4的说法正确的是( )A.1molO4中含
据报道,科学家已成功合成了少量O4(其结构式是),有关O4的说法正确的是( )A.1molO4中含有4NA个O-O键B.在O4分子中含有极性共价键C.O4是氧的一种
键能是指破坏(或形成)1 mol化学键所吸收(或放出)的能量。化学反应就是旧键断裂和新键形成的过程。
键能是指破坏(或形成)1 mol化学键所吸收(或放出)的能量。化学反应就是旧键断裂和新键形成的过程。现查得:H-H键,Cl-Cl键和H-Cl键的键能分别为436
下列各组物质中 化学键类型相同的是( )A.HI和NaIB.NaF和KClC.Cl2和NaOHD.
下列各组物质中,化学键类型相同的是( )A.HI和NaIB.NaF和KClC.Cl2和NaOHD.F2和NaBr












