(6分)按要求回答下列问题:(1)实验测得 5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和
| (6分)按要求回答下列问题: (1)实验测得,5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式 (2)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应生成正盐时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的热化学方程式 _____________ 。 (3)已知下列反应的焓变: ①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol ②C(s)+O2(g) =CO2(g) △H2=-393.5kJ/mol ③2 H2(g)+O2(g) =2H2O(l) △H3=-285.8kJ/mol 试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH= |
参考解答
| (1)2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452.8kJ/mol (2)1/2H2SO4(aq)+NaOH(aq)===1/2Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol (3)ΔH=-202.5KJ/mol |
| 考查热化学方程式的书写及反应热的计算。 (1)5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则2mol甲醇燃烧放出的热量是 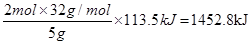 ,所以热化学方程式为 ,所以热化学方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452.8kJ/mol。 (2)热化学方程式为H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol。 (3)根据盖斯定律可知②×2+③-1即得到2C(s)+2H2(g)+O2(g) =CH3COOH(l),所以反应热是-393.5kJ/mol×2-285.8kJ/mol+870.3kJ/mol=-202.5KJ/mol。 |
相似问题
关于含正离子N5+的化合物N5ASF6 下列叙述中错误的是 A.N5+共有34个核外电子B
关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是A.N5+共有34个核外电子B.N5+中氮原子间以离子键结合C.化合物N5ASF6中AS的化合价为+1价D.化合物N5ASF6为离子化合物
既有离子键又有配位键的化合物是( )A.NH4NO3B.NaOHC.H2SO4D.H2O
既有离子键又有配位键的化合物是()A.NH4NO3B.NaOHC.H2SO4D.H2O
下列物质中其电子式可用表示的是:A.HClOB.NaHSC.KOHD.KClO
下列物质中其电子式可用表示的是:A.HClOB.NaHSC.KOHD.KClO
下列关于化学键的说法中正确的是A.化学键是一种静电引力B.化学键可以使离子结合 也可以使原子结合C.
下列关于化学键的说法中正确的是A.化学键是一种静电引力B.化学键可以使离子结合,也可以使原子结合C.只要有旧健的断裂就一定是化学反应D.氢键是一种化学键
(6分)下列物质:①与;②O2与O3;③正丁烷和异丁烷;④金刚石和石墨;⑤冰与水;⑥CH3CH2OH
(6分)下列物质:①与;②O2与O3;③正丁烷和异丁烷;④金刚石和石墨;⑤冰与水;⑥CH3CH2OH和CH3OCH3;⑦H2与D2。(1)互为同素异形体的是(2)互为同












