(7分)(1)用的混合溶液可溶出印刷电路板金属粉末中的铜。已知:==== △H=+64kJ/mol
(7分)(1)用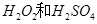 的混合溶液可溶出印刷电路板金属粉末中的铜。已知: 的混合溶液可溶出印刷电路板金属粉末中的铜。已知: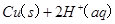 ==== ====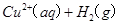 △H=+64kJ/mol △H=+64kJ/mol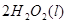 ==== ====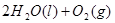 △H= -196kJ/mol △H= -196kJ/mol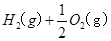 ="===" ="===" 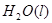 △H= -286kJ/mol △H= -286kJ/mol在 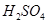 溶液中 溶液中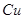 与 与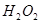 反应生成 反应生成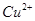 和 和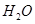 的热化学方程式为 。 的热化学方程式为 。(2)控制其他条件相同,印刷电路板的金属粉末用10℅ 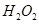 和3.0 mol/L的 和3.0 mol/L的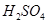 混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。 混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
(3)在提纯后的 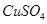 溶液中加入一定量的 溶液中加入一定量的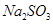 和 和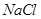 溶液,加热,生成 溶液,加热,生成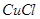 沉淀。制备 沉淀。制备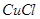 的离子方程式是 。 的离子方程式是 。 |
参考解答
| (1) Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-320.KJ.mol-1(3分) (2)H2O2分解速率加快 (2分) (3)2Cu2++SO32-+2Cl-+H2O 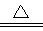 2CuCl↓+SO42-+2H+(2分) 2CuCl↓+SO42-+2H+(2分) |
| (1)考查盖斯定律的应用。由 ① 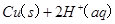 ==== ====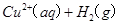 △H=+64kJ/mol; △H=+64kJ/mol;② 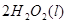 ==== ====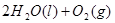 △H= -196kJ/mol; △H= -196kJ/mol;③ 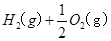 ='===' ='===' 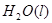 △H= -286kJ/mol知,①×2+②+③× △H= -286kJ/mol知,①×2+②+③×
(2)H2O2不稳定,受热易分解,因此随着温度的升高,H2O2的分解速率会增大,造成其浓度降低,故铜的平均溶解速率会随着反应温度升高而下降。 (3)CuSO4生成CuCl说明Cu的化合价降低了,即CuSO4作氧化剂,得到1个电子,Na2SO3作还原剂失去2个电子,其氧化产物是Na2SO4,所以反应的方程式为:2Cu2++SO32-+2Cl-+H2O  2CuCl↓+SO42-+2H+。 2CuCl↓+SO42-+2H+。 |
相似问题
下列关于化学理论学习和研究的说法错误的是 A.化学键的变化不一定会引起化学反应的变化B.外界条件改变
下列关于化学理论学习和研究的说法错误的是 A.化学键的变化不一定会引起化学反应的变化B.外界条件改变一定会引起化学反应的快慢变化C.化学模型的建立
(6分)下列是中学化学常见的物质A.金刚石 B.HCl C.NaCl D.Na2 SO4 E.Na2
(6分)下列是中学化学常见的物质A 金刚石 B HCl C NaCl D Na2 SO4 E Na2S F He G N2请用序号回答(1)-(4)题:(1)这些物质中只含共价键
已知由三种元素构成的四种物质存在下列反应 其中a的分子空间构型为正四面体。组成a分子的两种元素的原子
已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体。组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素
下列各组数值是相应元素的原子序数 其中所表示的原子能以离子键结合成稳定化合物的是 A.1与6B.2与
下列各组数值是相应元素的原子序数,其中所表示的原子能以离子键结合成稳定化合物的是A.1与6B.2与8C.9与11D.8与14
下列叙述正确的是( )A.金刚石和石墨是同种物质B.C60和CO2均是碳元素的化合物C.石墨
下列叙述正确的是()A.金刚石和石墨是同种物质B.C60和CO2均是碳元素的化合物C.石墨和C60是碳元素的同素异形体D.O3和C60同素异形体


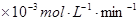 )
)









