已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:(1
| 已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题: (1)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H = 在量热计中(如图)将100 mL 0.50 mol/L的CH3COOH溶液与100 mL 0.55 mol/L NaOH溶液混合,温度从298.0 K升高到300.7 K.已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J/K,溶液密度均为1 g/mL,生成溶液的比热容c=4.184 J/(g·K).  (2) CH3COOH的中和热ΔH=_______________________________. (3)CH3COOH的中和热的文献值为-56.1 kJ/mol,你认为(1)中测得的实验值偏差可能的原因是(填二点)____________________________________________ |
参考解答
| (1)-1185kJ/mol(2分) (2)-53.3kJ/mol(2分) (3)①量热计的保温瓶效果不好;②酸碱溶液混合不迅速;③温度计不够精确等 |
试题分析:(1)单质硫的燃烧热为296 KJ·mol-1,则3mol单质S燃烧生成SO2时放出的热量是296 KJ·mol-1×3mol=88kJ;而生成的3molSO2再转化为3mol三氧化硫时又放出99kJ·mol-1×3mol=297kJ,所以由S(s)生成3 molSO3(g)的△H=-1185kJ/mol。 (2)醋酸的物质的量是0.050mol,氢氧化钠的物质的量是0.055mol,因此键过量,应该以酸的量计算生成的水的物质的量,即有0.050mol水生成。所以生成1mol水的反应热是△H= 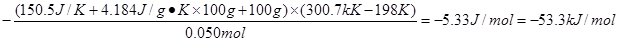 。 。(3)根据题意可知,反应中放出的热量减少,这说明反应中有热量的损失,所以可能的原因有①量热计的保温瓶效果不好;②酸碱溶液混合不迅速;③温度计不够精确等。 点评:该题在计算反应热时,也可以通过热化学方程式借助于盖斯定律进行;在分析实验误差时,该题属于开放性题目,学生只要能判断出反应过程中热量损失即可以分析出造成误差的原因。 |
相似问题
空间构型为正四面体 且键角为60°的物质为 A.金刚石B.SiO2C.白磷D.石墨
空间构型为正四面体,且键角为60°的物质为 A.金刚石B.SiO2C.白磷D.石墨
下列说法 正确的是A.离子键具有饱和性和方向性B.范德华力是分子间作用力的一种 氢键不属于分子间作用
下列说法,正确的是A.离子键具有饱和性和方向性B.范德华力是分子间作用力的一种,氢键不属于分子间作用力C.s轨道与s轨道之间可以在任何方向上成键,所
下列叙述正确的是 ( )A.含金属元素的离子一定是阳离子B.金属阳离子被还原一定得到
下列叙述正确的是()A.含金属元素的离子一定是阳离子B.金属阳离子被还原一定得到金属单质C.共价化合物中只含共价键D.1H、2H、3H互为同素异形体
下列对化学反应的认识 不正确的是A.化学反应必然引起物质状态的变化B.化学反应涉及化学键的断裂和生成
下列对化学反应的认识,不正确的是A.化学反应必然引起物质状态的变化B.化学反应涉及化学键的断裂和生成,而且还伴随着能量的变化C.化学反应速率的大小
下列分子中 键的极性最强的是 ( )A.PH3B.HFC.HBrD.HCl
下列分子中,键的极性最强的是()A.PH3B.HFC.HBrD.HCl












