随着科学技术的发展 石墨被广泛应用于化工 原子能等工业领域。(1)石墨的层状结构如图1所示 石墨中碳
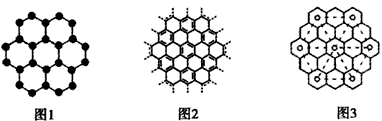
| 随着科学技术的发展,石墨被广泛应用于化工、原子能等工业领域。 (1)石墨的层状结构如图1所示,石墨中碳原子的杂化类型为___,图中7个六元环实际占有的碳原子数是___。 (2)由石墨可制石墨烯(如图2),下列有关石墨烯的说法正确的是___。 A.石墨烯的结构与金刚石相似 B.石墨烯分子中所有原子可以处于同一平面 C.12 g石墨烯含σ键数为NA D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力 (3)石墨能与熔融金属钾作用,形成蓝色的C24K、灰色的C48K、C60K等。有一种青铜色的CxK中K 原子(用。表示)的分布如图3所示,则x=___。 |
 |
参考解答
| (1)sp2; 14 (2)BD (3)8 |
相似问题
下列分子所含原子中 既有sp3杂化 也有sp2杂化的是 [ ]A.B. C.D.
下列分子所含原子中,既有sp3杂化、也有sp2杂化的是 [ ]A.B. C.D.
三氯化硼的熔点为-107℃ 沸点为12.5℃ 在其分子中键与键之间的夹角为120° 它能水解 有关叙
三氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是 [ ]A.三氯化硼液态时能导电而固态时不导电
下列化合物中既存在离子键 又存在极性键的是 ( ) A.H2OB.NH4ClC.N
下列化合物中既存在离子键,又存在极性键的是 ( )A.H2OB.NH4ClC.NaOHD.Na2O2
下列关于粒子结构的描述不正确的是[ ]A.H2S和NH3均是价电子总数为8的极性分子B.HS
下列关于粒子结构的描述不正确的是[ ]A.H2S和NH3均是价电子总数为8的极性分子B.HS-和HCl均是含一个极性键的18电子粒子C.CH2Cl2和CCl4均是四面体构型
下列说法中正确的是 [ ]A.含有离子键的化合物一定是离子化合物 B.所有物质中都存在化
下列说法中正确的是 [ ]A.含有离子键的化合物一定是离子化合物B.所有物质中都存在化学键 C.含有极性键的分子一定是极性分子D.氢键是一种强度介于












