在下图中 横坐标为某溶液中加入溶质的物质的量 纵坐标为生成沉淀的量:从A~D中选择符合表中各项要求填
| 在下图中,横坐标为某溶液中加入溶质的物质的量,纵坐标为生成沉淀的量: 从A~D中选择符合表中各项要求填入相应位置。  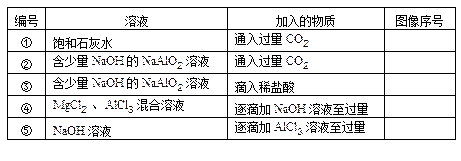 |
参考解答
| BCDAC</PGN0098B.TXT/PGN> |
| ①饱和石灰水中通入二氧化碳,立即生成沉淀,当通入过量二氧化碳时,沉淀逐渐溶解,当通入二氧化碳跟原溶液中氢氧化钙的物质的量比为2∶1时,沉淀完全溶解,反应的化学方程式是: Ca(OH)2+CO2====CaCO3↓+H2O CaCO3+CO2+H2O====Ca(HCO3)2 ②二氧化碳通入含氢氧化钠的偏铝酸钠溶液中,首先跟氢氧化钠反应,没有沉淀生成: 2NaOH+CO2====Na2CO3+H2O 把氢氧化钠都中和完以后,接着二氧化碳跟偏铝酸钠反应: NaAlO2+CO2+2H2O====Al(OH)3↓+NaHCO3 当偏铝酸钠反应完以后,再通入二氧化碳,沉淀不再增加,但是也不会溶解。 ③稀盐酸加到含氢氧化钠的偏铝酸钠溶液中时,首先中和氢氧化钠,没有沉淀生成: NaOH+HCl====NaCl+H2O 然后盐酸跟偏铝酸钠反应,生成沉淀,加入过量的盐酸时,生成的氢氧化铝沉淀又溶解于盐酸中: NaAlO2+HCl+H2O====Al(OH)3↓+NaCl Al(OH)3+3HCl====AlCl3+3H2O ④氢氧化钠逐滴加到氯化镁和氯化铝的混合溶液中,观察到有白色沉淀生成,沉淀逐渐增加: MgCl2+2NaOH====Mg(OH)2↓+2NaCl AlCl3+3NaOH====Al(OH)3↓+3NaCl 当溶液中的Mg2+、Al3+都用完时,沉淀量最大,再加过量的氢氧化钠溶液,沉淀开始减少,到氢氧化铝全部溶解时,沉淀的量不再减少: Al(OH)3+NaOH====NaAlO2+2H2O ⑤三氯化铝溶液逐滴加氢氧化钠溶液时,先观察到有白色沉淀,由于氢氧化钠过量,振荡,沉淀溶解,直至氢氧化钠消耗尽: AlCl3+3NaOH====Al(OH)3↓+3NaCl Al(OH)3+NaOH====NaAlO2+2H2O 继续滴加三氯化铝,有白色沉淀生成,沉淀量不断增加,当溶液中AlO2-离子消耗尽以后,再加三氯化铝,沉淀的量不变。 3NaAlO2+AlCl3+6H2O====4Al(OH)3↓ |
相似问题
下列说法中 正确的是( )A.氢键只存在于同一种分子之间B.金属阳离子只能与阴离子构成晶体C.
下列说法中,正确的是( )A.氢键只存在于同一种分子之间B.金属阳离子只能与阴离子构成晶体C.粒子间以分子间作用力结合的晶体,其熔点不会很高D.氮化
下列分子中 属于极性分子的是( )A.N2B.O2C.NH3D.CO2
下列分子中,属于极性分子的是()A.N2B.O2C.NH3D.CO2
HF H2O CH4 SiH4四种气态氢化物按稳定性由弱到强排列正确的是A.CH4<H2O<HF<S
HF、H2O、CH4、SiH4四种气态氢化物按稳定性由弱到强排列正确的是A.CH4<H2O<HF<SiH4B.SiH4<HF<CH4<H2OC.SiH4<CH4<H2O<HFD.H2O<CH4<HF<SiH4
已知离子键的键能与阴阳离子的电荷乘积成正比 与离子间的距离平方(可视为阴阳离子半径之和)成反比 若阳
已知离子键的键能与阴阳离子的电荷乘积成正比,与离子间的距离平方(可视为阴阳离子半径之和)成反比,若阳离子是Na+、K+、Rb+、Cs+,则其氯化物的熔点高
若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子 运用价层电子对互斥模型 下列说法正确的是
若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的是()A.若n=2,则分子的立体构型为V形B.若n=3,则












