回答以下问题:(1)Ni(CO)4是无色液体 沸点42.1℃ 熔点-19.3℃ 难溶于水 易溶于有机
| 回答以下问题: (1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是____________分子(填“极性”或“非极性”)。 (2)已知:波长为300nm的紫外光的光子所具有的 能量约为39 9 kJ/mol。 根据右表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:______________________________________________________________ _____________________________________________________________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。 ①N2H4分子中含有极性键的数目是___________ ;NH4+的空间构型是_______________。 ②肼可用作火箭燃料,燃烧时发生的反应是: N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1 若该 反应中有8mol N-H键断裂,则形成的π键有________mol。 (4)硼砂是含结晶水的四硼酸钠,其阴离子 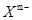 (含B、O、H三种元素)的球棍模型如图所示: (含B、O、H三种元素)的球棍模型如图所示: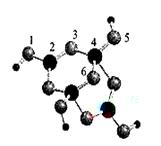 ①在 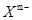 中,硼原子轨道的杂化类型有 和________;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。 中,硼原子轨道的杂化类型有 和________;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。②硼砂晶体由 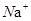 、 、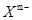 和 和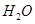 构成,它们之间存在的作用力有 (填序号)。 构成,它们之间存在的作用力有 (填序号)。A.共价键 B.离子键 C. 氢键 D.范德华力 E. 金属键 |
参考解答
| (1)非极性(1分) (2)紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子 (2分) (3)①4(1分) 正四面体 (1分)② 6mol(1分) (4)①SP2杂化 (1分) SP3杂化(1分) 4、5(1分),m=2(1分) ②B C D(2分,漏选得1分,有错选不得分) |
试题分析:(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂,因为水为极性溶剂,而有机溶剂为非极性溶剂,根据相似相溶的原理可以知道其为非极性分子;(2)波长为300nm的紫外光的光子所具有的能量约为39 9 kJ/mol,而蛋白质中各种键的键能都比该能量小,所以人体长时间照射紫外光后皮肤易受伤害的原因为:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子;(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。①N2H4分子中含有极性键的数目是4个,而非极性键为1个,NH4+的空间构型是正四面体;②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1,若该反应中有8mol N-H键断裂,说明有2mol的肼反应,则生成3mol氮气,一个氮气含有两个π,则形成的π键有6mol,(4)①1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间.观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,②钠离子与Xm-形成离子键,结晶水分子间存在氢键和范德华力,故答案为:BCD。 点评:本题考查了极性分子与非极性分子、分子空间构型、杂化类型、分子间作用力,这些考点是高考考查的重点和难点,本题综合性强,难点较大。 |
相似问题
据报道 某些不合格的大理石装潢材料中含有的放射性同位素氡严重超过规定标准 对人体造成伤害。该同位素原
据报道,某些不合格的大理石装潢材料中含有的放射性同位素氡严重超过规定标准,对人体造成伤害。该同位素原子中的中子数与核外电子数之差为[ ]A.136 B
水是生命之源 下列关于水的表达正确的是A.H2O分子的比例模型B.H2O和D2O与互为同分异构体C.
水是生命之源,下列关于水的表达正确的是A.H2O分子的比例模型B.H2O和D2O与互为同分异构体C.H2O分子和H2S分子都是极性分子 D.H2O沸点高于H2S,是因为
羰基硫(OCS)是一种有臭鸡蛋气味的无色气体 分子结构与CO2相似 高温下分解为CO和S。下列有关说
羰基硫(OCS)是一种有臭鸡蛋气味的无色气体,分子结构与CO2相似,高温下分解为CO和S。下列有关说法正确的是( )A.OCS、CO、CO2、S四种物质的晶体类型相同
1919年 langmuir提出等电子原理:原子数相同 最外层电子总数相同的分子 互称为等电子体。等
1919年,langmuir提出等电子原理:原子数相同、最外层电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。(1)根据上述原理,仅由
固体NH5属于离子晶体。它与水反应的化学方程式为NH5+H2O→NH3·H2O+H2↑ 它也能跟乙醇
固体NH5属于离子晶体。它与水反应的化学方程式为NH5+H2O→NH3·H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是A.含有NH4+












