A B C D E均为短周期元素 且原子序数逐渐增大.A D最外层电子数相等且能形成离子化合物 A与
| A、B、C、D、E均为短周期元素,且原子序数逐渐增大.A、D最外层电子数相等且能形成离子化合物,A与B的质子数之和等于C的质子数,A+与 C2-的核外电子数之和等于D+离子的核外电子数,B 原子与 D+离子的核外电子数之和等于 E 原子的核外电子数. (1)B的元素符号为______,E的原子结构示意图______;由A、C、E三种元素组成的化合物具有漂白性,其电子式为______. (2)将少量的D2C2投入到Na2S溶液中,产生浑浊现象,则反应的离子方程式为______. (3)A、B、C三种元素可组成多种化合物,请写出两种水溶液呈酸性的化合物,其中甲物质促进水的电离______,物质乙抑制水的电离______;室温下,若两溶液的pH都为4,则两溶液中水电离的氢离子浓度比为:甲:乙=______ (4)A与B化合形成10电子化合物丙,A与E化合形成18电子化合物丁;常温下,pH=11的丙溶液与pH=3的丁溶液等体积混合后溶液的pH______7(填“>”“<”“=”),溶液中离子浓度由大到小的顺序为______. (5)A2与C2可构成燃烧电池,若电解质溶液为KOH溶液,该电池的负极反应为______. |
参考解答
| A、B、C、D、E均为短周期元素,且原子序数逐渐增大.A、D最外层电子数相等,则为同族元素,且A、D能形成离子化合物,该族含有金属与非金属,为短周期元素,故为第ⅠA族,结合A、D原子序数可知,A为氢元素,D为钠元素;A+与 C2-的核外电子数之和等于D+离子的核外电子数,则C的质子数为10-2=8,故C为氧元素;A与B的质子数之和等于C的质子数,则B的质子数为8-1=7,故B为氮元素;B 原子与 D+离子的核外电子数之和等于 E 原子的核外电子数,则E的核外电子数为7+10=17,故E为氯元素. 故A为氢元素,B为氮元素;C为氧元素;D为钠元素;E为氯元素. (1)由上述分析可知,B为N元素;E为氯元素,原子核外有17个电子,有3个电子层,最外层有7个电子,原子结构示意图为 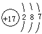 ;由A、C、E三种元素组成的化合物具有漂白性,该化合物为HClO,分子中氧原子分别通过1对共用电子对与氢原子、氯原子连接,其电子式为  , 故答案为:N; 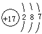 ;  ; (2)将少量的Na2O2投入到Na2S溶液中,过氧化钠具有强氧化性,将硫离子氧化为S单质,产生浑浊现象,同时生成氢氧化钠,则反应的离子方程式为 2H2O+S2-+Na2O2═4OH-+S↓+2Na+, 故答案为:2H2O+S2-+Na2O2═4OH-+S↓+2Na+; (3)A为氢元素,B为氮元素;C为氧元素;A、B、C三种元素可组成多种化合物,水溶液呈酸性的化合物,为酸或强酸弱碱盐,其中甲物质促进水的电离,甲为盐,则甲为NH4NO3,物质乙抑制水的电离,乙为酸,则乙为HNO3;室温下,若两溶液的pH都为4,NH4NO3溶液中氢离子为水电离氢离子,浓度为10-4mol/L,硝酸中水电离的氢离子浓度等于溶液中氢氧根离子浓度,浓度为
故答案为:NH4NO3;HNO3;106; (4)A与B化合形成10电子化合物丙为NH3,A与E化合形成18电子化合物丁为HCl,常温下,pH=11的丙溶液中氢氧根离子浓度为10-3mol/L,pH=3的丁溶液中氢离子浓度为10-3mol/L,氨水是弱电解质,电离程度不大,等体积混合后溶液中氨水有剩余,为氯化铵与氨水混合液,剩余氨水浓度远大于氯化铵浓度,一水合氨的电离程度大于铵根离子的水解程度C(NH4+)>C(Cl-),C(OH-)>C(H+),所以溶液的pH>7,溶液中离子浓度由大到小的顺序为C(NH4+)>C(Cl-)>C(OH-)>C(H+), 故答案为:;C(NH4+)>C(Cl-)>C(OH-)>C(H+); (5)H2与O2构成燃烧电池,若电解质溶液为KOH溶液,负极发生氧化反应,氢气在负极放电,在碱性条件下生成水,该电池的负极反应为 H2+2e-+2OH-=2H2O, 故答案为:H2+2e-+2OH-=2H2O. |
相似问题
已知1-18号元素的离子aW3+和CY2-具有相同的电子层结构 下列关系正确的是( )A.质子数c
已知1-18号元素的离子aW3+和CY2-具有相同的电子层结构,下列关系正确的是( )A.质子数c>aB.离子半径W3+>Y2-C.W和Y两元素在周期表中位于同一周期
下列有关结构和性质的说法中 正确的是( )A.酸性:HCl>H2S 所以 非金属性:Cl>SB
下列有关结构和性质的说法中,正确的是( )A.酸性:HCl>H2S,所以,非金属性:Cl>SB.元素原子的最外层电子数越多,越容易得电子,非金属性越
A元素原子最外层电子数为a 次外层电子数为b;B元素的原子M层电子数为a-b L层电子数为a+b;则
A元素原子最外层电子数为a,次外层电子数为b;B元素的原子M层电子数为a-b,L层电子数为a+b;则对AB两元素形成的化合物晶体叙述正确的是( )A.分子晶
A B C D是短周期的四种元素 其原子序数依次增大.已知A D同主族 C D同周期 A原子L层电子
A、B、C、D是短周期的四种元素,其原子序数依次增大.已知A、D同主族,C、D同周期,A原子L层电子数是K层电子数的2倍,B原子最外层有6个电子,且A原子和D
香花石由前20号元素中的6种组成 其化学式为X3Y2(ZWR4)3T2 X Y Z为金属元素 Z的最
香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同主族,Y、Z、R、T位于同周期












