已知A B C为同一短周期的三种元素 它们的原子序数依次增大且和为40;A是该周期中(除稀有气体元素
| 已知A、B、C为同一短周期的三种元素,它们的原子序数依次增大且和为40;A是该周期中(除稀有气体元素外)原子半径最大的元素,B元素的原子核外M层上的电子数比K层上的电子数多1. (1)A原子的结构示意图为______;A元素在周期表中位置为______. (2)写出B的最高价氧化物与A的最高价氧化物对应水化物的溶液之间反应的离子方程式______. (3)A和C形成的化合物的电子式为______,该化合物的水溶液呈______性(填“酸”或“碱”). (4)A是该周期中(除稀有气体元素外)原子半径最大的元素,从原子结构上看其原因是______.A、B、C三元素形成简单离子的半径大小顺序为______.(用离子符号表示) (5)比较A、B单质活泼性的实验方法是______. |
参考解答
| A、B、C为同一短周期的三种元素,B元素的原子核外M层上的电子数比K层上的电子数多1,故B元素有3个电子层,最外层电子数为,故B为Al元素;A是该周期中(除稀有气体元素外)原子半径最大的元素,故A为Na元素;A、B、C的原子序数和为40,故C的原子序数为40-11-13=16,故C为S元素 (1)由上述分析可知,A为Na元素,原子核外有11个电子,有3个电子层,最外层电子数为1,原子的结构示意图为 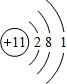 ;Na元素在周期表中位置为第三周期第ⅠA族. 故答案为: 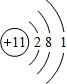 ;第三周期第ⅠA族. (2)B的最高价氧化物为Al2O3,A的最高价氧化物对应水化物为NaOH,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O. 故答案为:Al2O3+2OH-=2AlO2-+H2O. (3)A和C形成的化合物是Na2S,属于离子化合物,由钠离子与硫离子构成,电子式为  ;硫化钠溶液中硫离子水解,使溶液呈碱性. 故答案为:  ;碱. (4)同周期元素中Na元素原子的核电荷数最小,对最外层电子的引力越强,原子半径最大;最外层电子数相同电子层越多离子半径越多,电子层结构相同核电荷数越多离子半径越小,故离子半径S2->Na+>Al3+. 故答案为:电子层相同,核电荷数越小,对最外层电子的引力越,原子半径越大;S2->Na+>Al3+. (5)利用金属钠与去掉氧化膜的铝与水或盐酸反应,反应越剧烈,金属性越强,单质越活泼. 故答案为:利用金属钠与去掉氧化镁的铝与水或盐酸反应,反应越剧烈,金属性越强,单质越活泼. |
相似问题
三种元素X Y Z的原子 最外层电子数之和为17 核内质子数之和为31 则这三种元素是( )A.N
三种元素X、Y、Z的原子,最外层电子数之和为17,核内质子数之和为31,则这三种元素是( )A.N、P、ClB.P、O、SC.N、O、SD.O、F、Cl
元素X Y Z原子序数之和为33 X Y在同一周期 X+与Z2-具有相同的核外电子层结构.下列推测不
元素X、Y、Z原子序数之和为33,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测不正确的是( )A.同周期元素中X的金属性最强B.同族元素
现有甲 乙 丙 丁四种短周期元素 甲元素M电子层上的电子数是K电子层上电子数的一半;乙元素的单质在室
现有甲、乙、丙、丁四种短周期元素,甲元素M电子层上的电子数是K电子层上电子数的一半;乙元素的单质在室温下,冷的浓硫酸或空气中表面都能生成致密的氧
X Y Z三种元素的原子核外最外层电子数分别为1 4 6 则由这三种元素形成的化合物可能是( )A
X、Y、Z三种元素的原子核外最外层电子数分别为1、4、6,则由这三种元素形成的化合物可能是( )A.XYZ4B.X2YZ3C.XYZ3D.X2YZ4
有X Y Z三种元素 其中Y Z为短周期元素 ;X元素在周期表的第五周期 X的负价阴离子的原子核外电
有X、Y、Z三种元素,其中Y、Z为短周期元素,;X元素在周期表的第五周期,X的负价阴离子的原子核外电子排布与氙的原子核外电子排布相同;Z和X的原子最外层












