【化学――选修物质结构与性质】(15分)有A B C D E五种元素。其相关信息如下:请回答下列问
| 【化学――选修物质结构与性质】(15分) 有A、B、C、D、E五种元素。其相关信息如下:  请回答下列问题。 (1) 写出E元素原子基态时的电子排布式__________________; (2) C元素的第一电离能比氧元索的第一电离能 ______ ______ (填“大”或“小”); (3) CA3分子中C原子的杂化轨道类型是____________; (4) A、C、E三种元素可形成 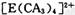 配离子,其中存在的化学键类型有 ______ (填序号); 配离子,其中存在的化学键类型有 ______ (填序号);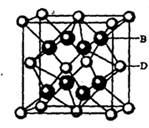 ①配位键 ②金属键③极性共价键④非极性共价键⑤离子键 ⑥氢键 若 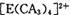 具有对称的空间构型,且当 具有对称的空间构型,且当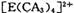 中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则 中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则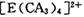 的空间构型为 ____________ (填序号); 的空间构型为 ____________ (填序号);a.平面正方形b.正四面体c.三角锥型 d. V型 (5) B与D可形成离子化合物,其晶胞结构如右图所示。其中D离子的配位数为_____,若该晶体的密度为ag ? cm-3,则该晶胞的体积是______cm-3(写出表达式即可)。 |
参考解答
| (1) 1s2 2s2 2p6 3s2 3p6 3d10 4s1或[Ar 3d10 4s1(2)大(3)sp3(4)①③;a (5) 8;(4×78/ NAa) cm3. |
| 本题考查物质结构与性质的有关知识。根据A、B、C、D、E五种元素的相关信息,可以推断出A、B、C、D、E五种元素分别是H、F、N、Ca、Cu。(1) Cu的基态电子排布式为1s2 2s2 2p6 3s2 3p6 3d10 4s1或[Ar 3d10 4s1(2)由于N的P电子满足洪特规则,能量降低,第一电离能升高,故N元素的第一电离能比氧元索的第一电离能大。(3)NH3中氮原子最外层有5个电子,与氢共用3个电子,达8电子结构。根据价层电子对互斥理论,四对电子的排布方式为四面体构形,根据杂化轨道理论,应为sp3杂化。(4)[Cu(NH3)42+中Cu与NH3通过配位键结合,NH3中N与H通过极性共价键结合。由于[Cu(NH3)42+是对称结构,且两个NH3被两个Cl-取代时,能得到两种不同结构的产物。如果[Cu(NH3)42+是正四面体结构,两个NH3被两个Cl-取代时,能得到一种产物,不合题意,故[Cu(NH3)42+是平面正方形结构。(5)F与Ca形成CaF2,从晶体结构可以看出,氟化钙结构又称萤石型结构,属等轴晶系,面心立方结构。氟化钙是AB2型离子晶体。其中阳离子A(Ca2+)呈立方密堆积,阴离子B(F-)填充在四面体空隙中,面心立方点阵对角线的1/4和3/4处。阴、阳离子的配位数分别为4和8。阳、阴离子半径比R2+/R->0.732。,所以一个氟化钙晶体中有4个氟化钙。该晶体的密度为ag ? cm-3,则该晶胞的体积是(4×78/ NAa) cm3。 |
相似问题
(8分)石墨的片层结构如图所示 试完成下列各题: (1)平均________个碳原子构成一个正六边
(8分)石墨的片层结构如图所示,试完成下列各题:(1)平均________个碳原子构成一个正六边形。(2)石墨晶体每一层内碳原子数与C—C化学键之比是________。(3
A B D E G M代表六种常见元素 它们的核电荷数依次增大。其中 元素M的基态3d轨道上有2个电
A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大。其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的简单离子
硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。如右图是该化合物的晶体结构单元:镁原子间形成正
硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。如右图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下面还各有一个镁原子;6个
下列物质呈固态时必定属于分子晶体的是( )A.非金属氧化物B.金属氧化物C.非金属单质D.常温下呈
下列物质呈固态时必定属于分子晶体的是( )A.非金属氧化物B.金属氧化物C.非金属单质D.常温下呈气态的物质
下列关于晶体的叙述中 错误的是A.每摩尔Si晶体中 含有2摩尔Si-Si共价键B.在CO2晶体中 与
下列关于晶体的叙述中,错误的是A.每摩尔Si晶体中,含有2摩尔Si-Si共价键B.在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子C.在CsCl晶体中,与每












