用价键理论写出下列配离子的电子构型 中心原子杂化轨道类型和配离子空间构型 并回答属内轨型配合物还是外
用价键理论写出下列配离子的电子构型、中心原子杂化轨道类型和配离子空间构型,并回答属内轨型配合物还是外轨型配合物。 (1)[Fe(en)2]2+μ=4.6μB (2)[Mn(CN)6]4—有一个未成对电子
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:(1)中心原子Fe2+的3d轨道上有6个电子其中4个单电子形成配合物后根据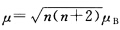 计算可知配合物中心原子3d轨道上未成对电子数仍为4。由此推知配合物的形成并未引起中心原子价电子的重排3d轨道未参与成键故中心原子d电子的排布及配离子的电子排布为:
计算可知配合物中心原子3d轨道上未成对电子数仍为4。由此推知配合物的形成并未引起中心原子价电子的重排3d轨道未参与成键故中心原子d电子的排布及配离子的电子排布为: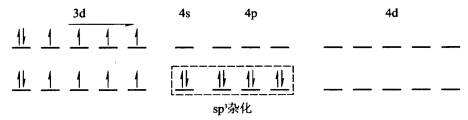 中心原子杂化轨道类型为sp3属于外轨型配合物空间构型为正四面体。(2)[Mn(CN)64—中Mn2+的3d轨道上有5个单电子配合物中n=1表明中心原子价电子发生重排有内层3d轨道参与成键故中心原子d电子的排布及配离子的电子排布为:
中心原子杂化轨道类型为sp3属于外轨型配合物空间构型为正四面体。(2)[Mn(CN)64—中Mn2+的3d轨道上有5个单电子配合物中n=1表明中心原子价电子发生重排有内层3d轨道参与成键故中心原子d电子的排布及配离子的电子排布为: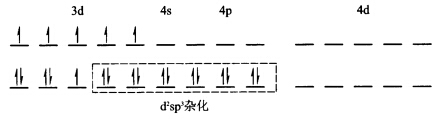 中心原子杂化轨道类型为d2sp3属内轨型配合物空间构型为正八面体。
中心原子杂化轨道类型为d2sp3属内轨型配合物空间构型为正八面体。
按照价键理论讨论配合物结构的基本思路:a.由实验测得的磁矩算出未成对电子数。b.推测中心原子的价电子的分布情况和采取的杂化方式。c.确定配合物是内轨型还是外轨型,进—步判断配合物的相对稳定性。
相似问题
螯合环越大 螯合物就越稳定。( )此题为判断题(对 错)。请帮忙给出正确答案和分析 谢谢!
螯合环越大,螯合物就越稳定。( )此题为判断题(对,错)。请帮忙给出正确答案和分析,谢谢!
某化合物 其相对分子质量Mr=125 摩尔吸收系数k=2.5×105L.mol—1.cm—1 今欲准
某化合物,其相对分子质量Mr=125,摩尔吸收系数k=2.5×105L.mol—1.cm—1,今欲准确配制该化合物溶液1L,使其在稀释200倍后,于1.00cm吸收池中测得的
下列物质不能作为基准物质的是( )。A.金属ZnB.Na2C2O4C.K2Cr2O7D.KMnO4请
下列物质不能作为基准物质的是( )。A.金属ZnB.Na2C2O4C.K2Cr2O7D.KMnO4请帮忙给出正确答案和分析,谢谢!
下列情况会产生系统误差的是( )。A.滴定管里出现气泡B.称量所用天平的砝码有锈蚀C.用仪器测定时电
下列情况会产生系统误差的是( )。A.滴定管里出现气泡B.称量所用天平的砝码有锈蚀C.用仪器测定时电压不稳定D.滴定管旋塞漏液请帮忙给出正确答案和分
量取H2O2试样25.00mL 稀释至250mL 再移取出25.00mL 加H2SO4酸化后 用0.
量取H2O2试样25.00mL,稀释至250mL,再移取出25.00mL,加H2SO4酸化后,用0.02732mol.L—1KMnO4标准溶液滴定,用去35.86mL。计算试样中取H2O2的质量












